Tetrafluorura de Xef4 sau Xenon este un compus chimic format din atomi de Xenon și fluorură. Este primul compus binar din lume descoperit. Este un tip de gaz nobil având ecuația chimică
Xe +2 F2- > XeF4
XeF4 are un aspect alb solid și are o densitate de 4,040 g cm−3 în formă solidă. În condiții obișnuite, apare ca un cristalin incolor. Are o temperatură sublimă de 115,7 grade Celsius sau 240,26 grade Fahrenheit. La fel ca celelalte fluoruri de Xenon, Tetrafluorura de Xenon are o formațiune exergonică. La temperatură și presiune normală, rămâne în stare stabilă. Reacționează instantaneu cu apa și eliberează oxigen molecular, fluorură de hidrogen și gaz xenon pur.
| Name of molecule | Xenon Tetrafluoride (XeF4) |
| No of Valence Electrons in the molecule | 36 |
| Hybridization of XeF4 | sp3d2 hybridization |
| Bond Angles | 90 degrees and 180 degrees |
| Molecular Geometry of XeF4 | Square Planar |
To know more about its physical properties and chemical properties, one needs to know its Structura Lewis și geometria moleculară. Să aflăm structura Lewis a Tetrafluorurii de Xenon.
pentru a face structura Lewis, trebuie să cunoaștem electronii de valență ai XeF4 pentru a-i face structura și a cunoaște plasarea atomilor în moleculă.
cuprins
xef4 electroni de valență
În această moleculă, avem un atom de Xenon și patru atomi de fluor. Vom calcula electronii de valență ai ambilor atomi pentru a determina numărul total de electroni de valență ai XeF4.
electroni de valență ai xenonului = 8
electroni de valență ai fluorului = 7*4 (deoarece există patru atomi de fluor, îl vom înmulți cu 4)
Numărul Total de electroni de valență ai Xef4: 8 + 7*4
: 8 + 28
: 36
prin urmare, există un total de 36 de electroni de valență în XeF4.
structura Xef4 Lewis
acum, că știm electronii de valență ai Tetrafluorurii de Xenon, vă va fi mai ușor să desenați structura Lewis. Această structură punct Lewis este o reprezentare picturală a electronilor de valență în jurul atomilor individuali dintr-o moleculă împreună cu legătura pe care o formează.
legăturile din structură sunt prezentate folosind linii, în timp ce electronii care nu participă la formarea legăturii sunt arătați ca puncte. Electronii care nu formează nicio legătură sunt numiți electroni nonbonding sau perechi singulare de electroni.
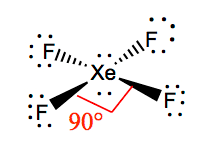
aici, deoarece xenonul este cel mai puțin electronegativ atom, îl vom plasa în centru și toți ceilalți atomi de fluor din jurul său astfel:

acum că am plasat toți atomii să arătăm legături între fiecare atom de fluor și Xenon. Fiecare legătură din moleculă preia doi electroni și, deoarece există patru legături simple în această moleculă, 8 electroni din 36 sunt epuizați.
începeți să plasați restul electronilor de valență în jurul atomilor. Fiecare atom de fluor va avea șase electroni de valență în jurul său, deoarece un electron a fost folosit pentru a face legătura. s-ar putea să observați că am plasat deja 24 de electroni din 28 în jurul atomilor de fluor. Restul de electroni care nu se leagă sau perechi de electroni singuri vor fi plasați pe Xenon, deoarece este o excepție de la regula octetului.
puneți aceste două perechi de electroni care nu se leagă pe Xenon, iar acum aveți o structură Lewis unde există două perechi singure de electroni pe Xenon și șase electroni care nu se leagă pe fiecare atom de fluor.
hibridizare XeF4
orbitalii atomului central de Xenon sunt hibridizați, ceea ce duce la formarea de noi orbitali hibridizați. Xenonul are șase electroni în orbitalii 5P și doi electroni în orbitalii 5s. Nu există electroni în D-orbitali și F-orbitali în starea de bază a xenonului. Dar când acest atom este într-o stare excitată, doi electroni din orbitalii p se deplasează la orbitalii d; ca rezultat, există patru electroni nepereche în total. Dintre care, doi sunt în p-orbitali, iar ceilalți doi electroni nepereche sunt în D-orbitali. Acești orbitali hibridizați duc la hibridizarea sp3d2 în XeF4.
Xef4 Geometrie moleculară
este mai ușor să înțelegem geometria moleculară a unei molecule date Odată ce îi cunoaștem structura Lewis. Deoarece Xenonul are două perechi de electroni singuri, va prelua o structură care ajută aceste perechi singure să evite forțele de repulsie. Pentru a menține aceste repulsii la minimum, perechile singure vor fi într-un plan perpendicular. Și deoarece există patru atomi de fluor, molecula va avea un aranjament astfel încât geometria sa moleculară să fie plană pătrată. XeF4 are o geometrie electronică a octaedrului, făcând geometria moleculară a Tetrafluorurii Xenon pătrat planar.

unghiuri de legătură XeF4
unghiurile de legătură ale F-Xe-F sunt de 90 de grade, iar perechile singure au unghiuri de 180 de grade. Atomii de fluor sunt localizați la 90 de grade unul față de celălalt, rezultând distribuția simetrică a electronilor în planul moleculei. Aceste unghiuri de legătură contribuie la formarea geometriei moleculare plane pătrate.
polaritatea XeF4 – este Polar sau nepolar XeF4?
deși legăturile dintre atomii de Xenon și fluor sunt polare, XeF4 este o moleculă nepolară. Vă întrebați cum? Toate legăturile Xe-F sunt în opoziție între ele reciproc, făcând suma momentului dipol zero. Deoarece există patru electroni pe atomul de Xenon, care sunt localizați ca perechi de electroni care nu se leagă. Deoarece aranjamentul general al atomilor și electronilor din moleculă este astfel încât suma vectorială a dipolilor este zero, XeF4 este o moleculă nepolară.
concluzii
Tetrafluorura de Xenon este una dintre acele molecule care este relativ ușor de înțeles. Structura sa Lewis este una dintre cele mai puțin complicate structuri, deoarece toți atomii de fluor sunt aranjați în modelul simetric. Perechile singure din moleculă sunt situate într-un plan perpendicular într-o formă octaedrică pentru a-și menține forțele respingătoare la minimum.
pentru a rezuma această postare pe blog, putem spune că XeF4 are 36 de electroni de valență. Are două perechi singulare de electroni care nu se leagă pe atomul central al xenonului. Molecula are geometrie electronică octaedrică și geometrie moleculară plană pătrată. XeF4 este o moleculă nepolară și are hibridizare sp3d2.