Il Xef4 o tetrafluoruro di xeno è un composto chimico costituito da atomi di xeno e fluoruro. È il primo composto binario al mondo scoperto. È un tipo di gas nobile avente l’equazione chimica di
Xe +2 F2- > XeF4
Lo XeF4 ha un aspetto bianco solido e ha una densità di 4,040 g cm−3 in forma solida. In condizioni ordinarie, appare come un cristallino incolore. Ha una temperatura sublime di 115,7 gradi Celsius o 240,26 gradi Fahrenheit. Come gli altri fluoruri di xeno, il tetrafluoruro di xeno ha una formazione exergonica. A temperatura e pressione normali, rimane nello stato stabile. Reagisce istantaneamente con l’acqua e rilascia ossigeno molecolare, fluoruro di idrogeno e gas xeno puro.
| Name of molecule | Xenon Tetrafluoride (XeF4) |
| No of Valence Electrons in the molecule | 36 |
| Hybridization of XeF4 | sp3d2 hybridization |
| Bond Angles | 90 degrees and 180 degrees |
| Molecular Geometry of XeF4 | Square Planar |
To know more about its physical properties and chemical properties, one needs to know its Struttura di Lewis e geometria molecolare. Scopriamo la struttura di Lewis del tetrafluoruro di Xeno.
Per fare la struttura di Lewis, abbiamo bisogno di conoscere gli elettroni di valenza di XeF4 per fare la sua struttura e conoscere il posizionamento degli atomi nella molecola.
Contenuto
Xef4 Elettroni di valenza
In questa molecola, abbiamo un atomo di Xeno e quattro atomi di fluoro. Calcoleremo gli elettroni di valenza di entrambi questi atomi per determinare il numero totale di elettroni di valenza di XeF4.
elettroni di Valenza di Xenon = 8
elettroni di Valenza di Fluoro = 7*4 ( come ci sono quattro gli atomi di Fluoro, possiamo moltiplicare per 4)
numero Totale di elettroni di valenza di Xef4: 8 + 7*4
: 8 + 28
: 36
Quindi ci sono un totale di 36 elettroni di valenza XeF4.
XeF4 Lewis Structure
Ora che conosciamo gli elettroni di valenza del tetrafluoruro di Xeno, sarà più facile per te disegnare la sua struttura di Lewis. Questa struttura a punti di Lewis è una rappresentazione pittorica di elettroni di valenza attorno a singoli atomi in una molecola insieme al legame che forma.
I legami nella struttura sono mostrati usando linee, mentre gli elettroni che non partecipano alla formazione del legame sono mostrati come punti. Gli elettroni che non formano alcun legame sono chiamati elettroni non conduttori o coppie solitarie di elettroni.
Qui poiché lo Xeno è l’atomo meno elettronegativo, lo posizioneremo al centro e tutti gli altri atomi di fluoro attorno ad esso in questo modo:

Ora che abbiamo posizionato tutti gli atomi mostriamo i legami tra ciascun atomo di fluoro e Xeno. Ogni legame nella molecola occupa due elettroni, e poiché ci sono quattro singoli legami in questa molecola, 8 elettroni su 36 sono esauriti.
Inizia a posizionare il resto degli elettroni di valenza attorno agli atomi. Ogni atomo di fluoro avrà sei elettroni di valenza intorno ad esso, come un elettrone è stato utilizzato per rendere il legame.
Potresti notare che abbiamo già posizionato 24 elettroni su 28 attorno agli atomi di fluoro. I restanti elettroni non conduttori o coppie solitarie di elettroni saranno posizionati sullo Xeno in quanto è un’eccezione alla regola dell’ottetto.
Posiziona queste due coppie di elettroni non conduttori sullo Xeno, e ora hai una struttura di Lewis dove ci sono due coppie di elettroni solitari sullo Xeno e sei elettroni non conduttori su ciascun atomo di fluoro.
Ibridazione XeF4
Gli orbitali dell’atomo di Xeno centrale sono ibridati, il che si traduce nella formazione di nuovi orbitali ibridati. Lo xeno ha sei elettroni nei suoi orbitali 5p e due elettroni negli orbitali 5s. Non ci sono elettroni negli orbitali d e negli orbitali f nello stato fondamentale dello Xeno. Ma quando questo atomo è in uno stato eccitato, due elettroni negli orbitali p si spostano negli orbitali d; di conseguenza, ci sono quattro elettroni spaiati in totale. Di cui, due sono in p-orbitali, e gli altri due elettroni spaiati sono in d-orbitali. Questi orbitali ibridati portano all’ibridazione sp3d2 in XeF4.
Geometria molecolare XeF4
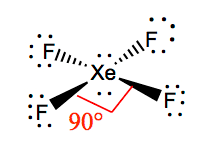
È più facile capire la geometria molecolare di una data molecola una volta che conosciamo la sua struttura di Lewis. Poiché lo Xeno ha due coppie solitarie di elettroni, occuperà una struttura che aiuta queste coppie solitarie a evitare le forze di repulsione. Per mantenere queste repulsioni al minimo, le coppie solitarie saranno in un piano perpendicolare. E poiché ci sono quattro atomi di fluoro, la molecola avrà una disposizione tale che la sua geometria molecolare sia quadrata planare. XeF4 ha una geometria elettronica di ottaedrica, rendendo la geometria molecolare del tetrafluoruro di xeno quadrato planare.

Angoli di legame XeF4
Gli angoli di legame di F-Xe-F sono di 90 gradi e le coppie solitarie hanno angoli di 180 gradi. Gli atomi di fluoro si trovano a 90 gradi l’uno rispetto all’altro, determinando la distribuzione simmetrica degli elettroni nel piano della molecola. Questi angoli di legame contribuiscono alla formazione della geometria molecolare planare quadrata.
Polarità XeF4-XeF4 è polare o non polare?
Sebbene i legami tra gli atomi di Xeno e fluoro siano polari, XeF4 è una molecola non polare. Chiedendosi come? Tutti i legami Xe-F sono in opposizione tra loro reciprocamente, rendendo la somma del momento di dipolo zero. Poiché ci sono quattro elettroni sull’atomo di Xeno, che sono localizzati come coppie di elettroni non vincolanti. Poiché la disposizione complessiva degli atomi e degli elettroni nella molecola è tale che la somma vettoriale dei dipoli è zero, XeF4 è una molecola non polare.
Osservazioni conclusive
Il tetrafluoruro di xeno è una di quelle molecole che è relativamente facile da capire. La sua struttura di Lewis è una delle strutture meno complicate, poiché tutti gli atomi di fluoro sono disposti nel modello simmetrico. Le coppie solitarie nella molecola si trovano in un piano perpendicolare in una forma ottaedrica per mantenere le loro forze repulsive al minimo.
Per riassumere questo post del blog, possiamo dire che XeF4 ha 36 elettroni di valenza. Ha due coppie solitarie di elettroni non conduttori sull’atomo centrale dello Xeno. La molecola ha geometria elettronica ottaedrica e geometria molecolare planare quadrata. XeF4 è una molecola non polare e ha ibridazione sp3d2.