tetrafluorek Xef4 lub ksenonu jest związkiem chemicznym zbudowanym z atomów ksenonu i fluorku. Jest to pierwszy na świecie odkryty związek binarny. Jest to rodzaj gazu szlachetnego o równaniu chemicznym
Xe +2 F2- >XeF4
XeF4 ma stały biały wygląd i ma gęstość 4,040 g cm−3 w postaci stałej. W zwykłych warunkach wygląda jak bezbarwny krystaliczny. Ma wzniosłą temperaturę 115,7 stopnia Celsjusza lub 240,26 stopnia Fahrenheita. Podobnie jak inne fluorki ksenonu, tetrafluorek ksenonu ma formację egzergoniczną. W normalnej temperaturze i ciśnieniu pozostaje w stabilnym stanie. Natychmiast reaguje z wodą i uwalnia tlen cząsteczkowy, fluorowodór i czysty ksenon.
| Name of molecule | Xenon Tetrafluoride (XeF4) |
| No of Valence Electrons in the molecule | 36 |
| Hybridization of XeF4 | sp3d2 hybridization |
| Bond Angles | 90 degrees and 180 degrees |
| Molecular Geometry of XeF4 | Square Planar |
To know more about its physical properties and chemical properties, one needs to know its Struktura Lewisa i geometria molekularna. Poznajmy strukturę Lewisa tetrafluorku ksenonu.
aby stworzyć strukturę Lewisa, musimy znać elektrony walencyjne XeF4, aby stworzyć jego strukturę i znać rozmieszczenie atomów w cząsteczce.
zawartość
elektrony walencyjne XeF4
w tej cząsteczce mamy jeden atom ksenonu i cztery atomy fluoru. Obliczymy elektrony walencyjne obu tych atomów, aby określić całkowitą liczbę elektronów walencyjnych XeF4.
elektrony walencyjne ksenonu = 8
elektrony walencyjne fluoru = 7*4 (ponieważ istnieją cztery atomy fluoru, pomnożymy je przez 4)
całkowita liczba elektronów walencyjnych Xef4: 8 + 7*4
: 8 + 28
: 36
stąd istnieje w sumie 36 elektronów walencyjnych w XeF4.
struktura Xef4 Lewisa
teraz, gdy znamy elektrony walencyjne Tetrafluorku ksenonu, łatwiej będzie narysować jego strukturę Lewisa. Ta struktura kropki Lewisa jest obrazową reprezentacją elektronów walencyjnych wokół poszczególnych atomów w cząsteczce wraz z wiązaniem, które tworzy.
wiązania w strukturze są pokazane za pomocą linii, podczas gdy elektrony nie uczestniczące w tworzeniu wiązania są pokazane jako kropki. Elektrony, które nie tworzą żadnego wiązania, nazywane są elektronami niezwiązanymi lub samotnymi parami elektronów.
tutaj, ponieważ ksenon jest najmniej elektroujemnym atomem, umieścimy go w centrum, a wszystkie inne atomy fluoru wokół niego w ten sposób:

teraz, gdy umieściliśmy wszystkie atomy, pokażmy wiązania między każdym atomem fluoru i ksenonu. Każde Wiązanie w cząsteczce zajmuje dwa elektrony, a ponieważ istnieją cztery pojedyncze wiązania w tej cząsteczce, zużywa się 8 elektronów z 36.
zacznij umieszczać resztę elektronów walencyjnych wokół atomów. Każdy atom fluoru będzie miał wokół siebie sześć elektronów walencyjnych, ponieważ jeden elektron został użyty do wytworzenia wiązania.
możesz zauważyć, że umieściliśmy już 24 elektrony z 28 wokół atomów fluoru. Pozostałe elektrony lub pojedyncze pary elektronów zostaną umieszczone na Ksenonie, ponieważ jest to wyjątek od reguły oktetu.
umieść te dwie pary niezbondujących elektronów na Ksenonie, a teraz masz strukturę Lewisa, w której są dwie samotne pary elektronów na Ksenonie i sześć niezbondujących elektronów na każdym atomie fluoru.
hybrydyzacja XeF4
orbitale centralnego atomu ksenonu są hybrydyzowane, co powoduje powstanie nowych hybrydyzowanych orbitali. Ksenon ma sześć elektronów na orbitalach 5p i dwa elektrony na orbitalach 5s. Nie ma elektronów w orbitalach d i F w stanie podstawowym ksenonu. Ale kiedy ten atom jest w stanie wzbudzonym, dwa elektrony w orbitalach p poruszają się do orbitali d; w rezultacie są cztery niesparowane elektrony w sumie. Z których dwa znajdują się na orbitalach p, a pozostałe dwa niesparowane elektrony są na orbitalach D. Te hybrydyzowane orbitale prowadzą do hybrydyzacji sp3d2 w XeF4.
Geometria molekularna XeF4
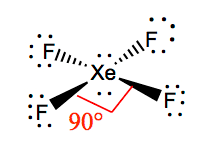
łatwiej jest zrozumieć geometrię molekularną danej cząsteczki, gdy znamy jej strukturę Lewisa. Ponieważ ksenon ma dwie samotne pary elektronów, zajmie strukturę, która pomaga tym samotnym parom uniknąć sił odpychania. Aby utrzymać te odpychania na minimalnym poziomie, samotne pary będą w prostopadłej płaszczyźnie. A ponieważ istnieją cztery atomy fluoru, cząsteczka będzie miała taki układ, że jej geometria molekularna będzie kwadratowa. XeF4 ma elektroniczną geometrię ośmiościanu, co czyni geometrię molekularną Tetrafluorku ksenonu kwadratowym planarnym.

xef4 kąty wiązania
kąty wiązania f-Xe-F wynoszą 90 stopni, a pojedyncze pary mają kąty 180 stopni. Atomy fluoru znajdują się pod kątem 90 stopni względem siebie, co powoduje symetryczny rozkład elektronów w płaszczyźnie cząsteczki. Te kąty wiązania przyczyniają się do tworzenia kwadratowej płaskiej geometrii molekularnej.
Polaryzacja XeF4 – czy XeF4 jest polarny czy niepolarny?
chociaż wiązania między atomami ksenonu i fluoru są polarne, XeF4 jest cząsteczką niepolarną. Zastanawiasz się jak? Wszystkie wiązania Xe-F są ze sobą w opozycji, co sprawia, że suma momentu dipolowego wynosi zero. Ponieważ na atomie ksenonu znajdują się cztery elektrony, które są zlokalizowane jako nieliczne pary elektronów. Ponieważ ogólny układ atomów i elektronów w cząsteczce jest taki, że suma wektorowa dipoli wynosi zero, XeF4 jest cząsteczką niepolarną.
Uwagi końcowe
tetrafluorek ksenonu jest jedną z tych cząsteczek, które są stosunkowo łatwe do zrozumienia. Jego struktura Lewisa jest jedną z najmniej skomplikowanych struktur, ponieważ wszystkie atomy fluoru są ułożone symetrycznie. Pojedyncze pary w cząsteczce znajdują się w prostopadłej płaszczyźnie w kształcie ośmiościanu, aby utrzymać swoje siły odpychające na minimalnym poziomie.
podsumowując ten post na blogu, możemy powiedzieć, że XeF4 ma 36 elektronów walencyjnych. Ma dwie samotne pary elektronów niezwiązanych z centralnym atomem ksenonu. Cząsteczka ma ośmiościanową geometrię elektronową i kwadratową płaską geometrię molekularną. XeF4 jest cząsteczką niepolarną i ma hybrydyzację sp3d2.