XeF4 Eller Xenon Tetrafluoride Er en kjemisk forbindelse laget Av Xenon og Fluor atomer. Det er verdens første binære forbindelse oppdaget. Det er en type edelgass som har den kjemiske ligningen
Xe + 2 f2 – > XeF4
XeF4 har et fast hvitt utseende og har en tetthet på 4,040 g cm−3 i fast form. Under vanlige forhold ser det ut som en fargeløs krystallinsk. Den har en sublime temperatur på 115,7 grader Celsius eller 240,26 grader Fahrenheit. På samme måte som De Andre Xenonfluoridene har Xenontetrafluoridet en eksergonisk formasjon. Ved normal temperatur og trykk forblir den i stabil tilstand. Det reagerer med vann umiddelbart og frigjør molekylært oksygen, hydrogenfluorid og ren xenongass.
| Name of molecule | Xenon Tetrafluoride (XeF4) |
| No of Valence Electrons in the molecule | 36 |
| Hybridization of XeF4 | sp3d2 hybridization |
| Bond Angles | 90 degrees and 180 degrees |
| Molecular Geometry of XeF4 | Square Planar |
To know more about its physical properties and chemical properties, one needs to know its Lewis struktur og molekylær geometri. La Oss finne Ut Lewis-strukturen Av Xenontetrafluorid.
For Å lage Lewis-strukturen må vi kjenne valenselektronene Til XeF4 for å gjøre strukturen og kjenne plasseringen av atomer i molekylet.
Innhold
XeF4 Valenselektroner
i dette molekylet har vi Ett Atom Xenon og fire atomer Av Fluor. Vi vil beregne valenselektronene til begge disse atomene for å bestemme totalt antall valenselektroner Av XeF4.
Valenselektroner Av Xenon = 8
Valenselektroner Av Fluor = 7*4 (da det er fire Fluoratomer, vil vi multiplisere det med 4)
Totalt antall valenselektroner Av Xef4: 8 + 7*4
: 8 + 28
: 36
Derfor er det totalt 36 valenselektroner I XeF4.
XeF4 Lewis Struktur
Nå som vi kjenner Valenselektronene Til Xenontetrafluorid, blir det lettere for deg å tegne Sin Lewis-struktur. Denne Lewis dot-strukturen er en billedlig representasjon av valenselektroner rundt individuelle atomer i et molekyl sammen med bindingen det danner.
bindingene i strukturen vises ved hjelp av linjer, mens elektronene som ikke deltar i bindingsdannelsen, vises som prikker. Elektroner som ikke danner noen binding kalles nonbonding elektroner eller lone par elektroner.
Her Som Xenon er det minst elektronegative atom, vil vi plassere det i midten og alle de andre fluoratomer rundt det slik:

Nå som vi har plassert alle atomene, la oss vise bindinger mellom Hvert Fluor og Xenonatom. Hver binding i molekylet tar opp to elektroner, og da det er fire enkeltbindinger i dette molekylet, blir 8 elektroner ut av 36 brukt opp.
begynn å plassere resten av valenselektronene rundt atomene. Hvert fluoratom vil ha seks valenselektroner rundt seg, da en elektron ble brukt til å gjøre bindingen.
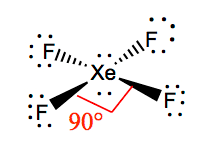
Du kan legge merke til at vi allerede har plassert 24 elektroner ut av 28 rundt fluoratomer. De resterende nonbonding elektroner eller lone par elektroner vil bli plassert På Xenon som det er et unntak fra oktett regelen. Plasser disse to parene av nonbonding elektroner På Xenon, og nå har Du En Lewis struktur der det er to ensomme par elektroner På Xenon og seks nonbonding elektroner på Hvert Fluoratom.
Xef4 Hybridisering
det sentrale Xenonatomets orbitaler hybridiseres, noe som resulterer i dannelsen av nye hybridiserte orbitaler. Xenon har seks elektroner i sine 5p orbitaler og to elektroner i 5s orbitaler. Det er ingen elektroner i d-orbitaler og f-orbitaler i Grunntilstanden Til Xenon. Men når dette atomet er i en opphisset tilstand, flytter to elektroner i p-orbitaler til d-orbitaler; som et resultat er det totalt fire uparede elektroner. Av disse er to i p-orbitaler, og de andre to uparede elektronene er i d-orbitaler. Disse hybridiserte orbitaler fører til sp3d2 hybridisering I XeF4.
Xef4 Molekylær Geometri
det er lettere å forstå molekylær geometri av et gitt molekyl når Vi kjenner Sin Lewis-struktur. Som Xenon har to ensomme par elektroner, vil det ta opp en struktur som hjelper disse ensomme parene til å unngå avstøtningskreftene. For å holde disse avstøtningene på et minimum, vil de ensomme parene være i et vinkelrett plan. Og da det er fire fluoratomer, vil molekylet ha et arrangement slik at dets molekylære geometri er firkantet plan. XeF4 har en elektronisk geometri av oktaedisk, noe som gjør molekylær geometri Av Xenon Tetrafluorid firkantet plan.

XeF4 Bindingsvinkler
bindingsvinklene Til F-Xe-F er 90 grader, og ensomme par har vinkler på 180 grader. Fluoratomer er plassert 90 grader til hverandre, noe som resulterer i symmetrisk fordeling av elektronene i molekylets plan. Disse bindingsvinklene bidrar til dannelsen av kvadratisk plan molekylær geometri.
XeF4 Polaritet – Er XeF4 Polar eller Ikke-Polar?
selv om bindingene Mellom Xenon og Fluoratomer er polare, Er XeF4 et ikke-polært molekyl. Lurer på hvordan? Alle Xe-F-bindingene er i opposisjon med hverandre gjensidig, noe som gjør summen av dipolmoment null. Som det er fire elektroner På Xenonatomet, som er lokalisert som ikke-bundet par elektroner. Da det totale arrangementet av atomer og elektroner i molekylet er slik at vektorsummen av dipolene er null, Er XeF4 et ikke-polært molekyl.
Avsluttende Bemerkninger
Xenontetrafluorid er et av de molekylene som er relativt lett å forstå. Lewis-strukturen er en av de minst kompliserte strukturer, da Alle Fluoratomer er arrangert i det symmetriske mønsteret. De ensomme parene i molekylet befinner seg i et vinkelrett plan i en oktaedisk form for å holde sine repulsive krefter på et minimum. for å oppsummere dette blogginnlegget kan Vi si At XeF4 har 36 valenselektroner. Den har to ensomme par nonbonding elektroner på Det sentrale Atom Av Xenon. Molekylet har oktaedrisk elektrongeometri og kvadratisk plan molekylær geometri. XeF4 er et ikke-polart molekyl og har sp3d2 hybridisering.