tetrafluorid er en kemisk forbindelse, der er fremstillet af atomer af fluorid og fremmedstof. Det er verdens første binære forbindelse opdaget. Det er en type ædelgas, der har den kemiske ligning af
KSE +2 F2- > Ksef4
Ksef4 har et solidt hvidt udseende og har en densitet på 4,040 g cm−3 i fast form. Under almindelige forhold ser det ud som en farveløs krystallinsk. Det har en sublim temperatur på 115,7 grader Celsius eller 240,26 grader Fahrenheit. Tetrafluorid har en eksergonisk formation. Ved normal temperatur og tryk forbliver den i stabil tilstand. Det reagerer med vand øjeblikkeligt og frigiver molekylært ilt, hydrogenfluorid og ren fremmedgas.
| Name of molecule | Xenon Tetrafluoride (XeF4) |
| No of Valence Electrons in the molecule | 36 |
| Hybridization of XeF4 | sp3d2 hybridization |
| Bond Angles | 90 degrees and 180 degrees |
| Molecular Geometry of XeF4 | Square Planar |
To know more about its physical properties and chemical properties, one needs to know its Struktur og molekylær geometri. Lad os finde ud af strukturen af ksenon tetrafluorid.
for at lave strukturen skal vi kende valenselektronerne i Ksef4 for at gøre dens struktur og kende placeringen af atomer i molekylet.
indhold
Ksef4 valenselektroner
i dette molekyle har vi et atom af Ksenon og fire atomer af fluor. Vi beregner valenselektronerne for begge disse atomer for at bestemme det samlede antal valenselektroner af Hsef4.8
valenselektroner af fluor = 7*4 (da der er fire fluoratomer, vil vi multiplicere det med 4)
samlet antal valenselektroner af Ksef4: 8 + 7*4
: 8 + 28
: 36
derfor er der i alt 36 valenselektroner i Hsef4.
Ksef4 struktur
nu hvor vi kender valenselektronerne af Ksenontetrafluorid, vil det være lettere for dig at tegne dens struktur. Denne skæve prikstruktur er en billedlig repræsentation af valenselektroner omkring individuelle atomer i et molekyle sammen med den binding, det danner.
bindingerne i strukturen vises ved hjælp af linjer, hvorimod elektronerne, der ikke deltager i bindingsdannelsen, vises som prikker. Elektroner, der ikke danner nogen binding, kaldes ikke-bindende elektroner eller ensomme par elektroner.
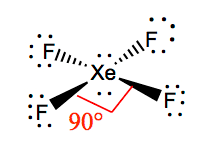
her som Ksenon er det mindste elektronegative atom, vil vi placere det i midten og alle de andre fluoratomer omkring det sådan:

nu hvor vi har placeret alle atomer lad os vise bindinger mellem hvert fluor og Ksenonatom. Hver binding i molekylet optager to elektroner, og da der er fire enkeltbindinger i dette molekyle, bruges 8 elektroner ud af 36 op.
begynd at placere resten af valenselektronerne omkring atomerne. Hvert fluoratom vil have seks valenselektroner omkring sig, da en elektron blev brugt til at gøre bindingen.
du bemærker måske, at vi allerede har placeret 24 elektroner ud af 28 omkring fluoratomerne. De resterende ikke-bindende elektroner eller ensomme par elektroner placeres på Ksenon, da det er en undtagelse fra oktetreglen.
Placer disse to par ikke-bindende elektroner på Ksenon, og nu har du en struktur, hvor der er to ensomme par elektroner på Ksenon og seks ikke-bindende elektroner på hvert fluoratom.
Ksef4 hybridisering
det centrale Ksenonatoms orbitaler hybridiseres, hvilket resulterer i dannelsen af nye hybridiserede orbitaler. Der er seks elektroner i 5P orbitaler og to elektroner i 5S orbitaler. Der er ingen elektroner i d-orbitaler og f-orbitaler i jordtilstanden Ksenon. Men når dette atom er i en ophidset tilstand, flytter to elektroner i p-orbitalerne til d-orbitaler; som et resultat er der i alt fire uparrede elektroner. Hvoraf to er i p-orbitaler, og de to andre uparrede elektroner er i d-orbitaler. Disse hybridiserede orbitaler fører til sp3d2 hybridisering i Ksef4.
molekylær geometri
det er lettere at forstå molekylær geometrien af et givet molekyle, når vi kender dets struktur. Da Ksenon har to ensomme par elektroner, vil det tage en struktur, der hjælper disse ensomme par med at undgå frastødningskræfterne. For at holde disse afstødninger på et minimum, vil de ensomme par være i et vinkelret plan. Og da der er fire fluoratomer, vil molekylet have et arrangement, således at dets molekylære geometri er firkantet plan. Ksef4 har en elektronisk geometri af oktaedrisk, hvilket gør molekylær geometri af Ksenon tetrafluorid firkantet plan.

Ksef4 Bindingsvinkler
bindingsvinklerne for F-KSE-F er 90 grader, og ensomme par har vinkler på 180 grader. Fluoratomerne er placeret 90 grader i forhold til hinanden, hvilket resulterer i den symmetriske fordeling af elektronerne i molekylets plan. Disse bindingsvinkler bidrager til dannelsen af firkantet plan molekylær geometri.
Ksef4 polaritet – er Ksef4 polær eller ikke-polær? h2
selvom bindingerne mellem Ksenon-og fluoratomer er polære, er Ksef4 et ikke-polært molekyle. Gad vide hvordan? Alle obligationer er i modsætning til hinanden gensidigt, hvilket gør summen af dipolmoment nul. Da der er fire elektroner på Ksenonatomet, som er lokaliseret som ikke-bindende par af elektroner. Da det samlede arrangement af atomer og elektroner i molekylet er sådan, at vektorsummen af dipolerne er nul, er Ksef4 et ikke-polært molekyle.
afsluttende bemærkninger
Ksenontetrafluorid er et af de molekyler, der er relativt let at forstå. Dens struktur er en af de mindst komplicerede strukturer, da alle fluoratomer er arrangeret i det symmetriske mønster. De ensomme par i molekylet er placeret i et vinkelret plan i en oktaedrisk form for at holde deres frastødende kræfter på et minimum.
for at opsummere dette blogindlæg kan vi sige, at Ksef4 har 36 valenselektroner. Det har to ensomme par ikke-bindende elektroner på det centrale atom i Ksenon. Molekylet har oktaedrisk elektrongeometri og firkantet plan molekylær geometri. Ksef4 er et ikke-polært molekyle og har sp3d2 hybridisering.