Xef4またはキセノンのTetrafluorideはキセノンおよびフッ化物原子から成っている化学化合物です。 それは発見された世界の最初二成分の混合物です。 これは、化学式を有する希ガスの一種である
Xe+2F2->Xef4
Xef4は、固体白色の外観を有し、固体形態で4.040g cm−3の密度を有する。 通常の条件下では、無色の結晶のように見える。 それは摂氏115.7度または華氏240.26度の崇高な温度を持っています。 他のフッ化キセノンと同じように、四フッ化キセノンはエクセルゴン形成を有する。 正常な温度および圧力で、それは安定した状態にとどまります。 それは水と直ちに反応し、分子酸素、フッ化水素および純粋なキセノンのガスを解放します。
| Name of molecule | Xenon Tetrafluoride (XeF4) |
| No of Valence Electrons in the molecule | 36 |
| Hybridization of XeF4 | sp3d2 hybridization |
| Bond Angles | 90 degrees and 180 degrees |
| Molecular Geometry of XeF4 | Square Planar |
To know more about its physical properties and chemical properties, one needs to know its ルイス構造と分子幾何学。 四フッ化キセノンのLewis構造を調べてみましょう。
ルイス構造を作るためには、その構造を作るためにXef4の価電子を知り、分子中の原子の配置を知る必要があります。
内容
Xef4価電子
この分子には、キセノンの1つの原子とフッ素の4つの原子があります。 これらの原子の両方の価電子を計算して、Xef4の価電子の総数を決定します。
キセノンの価電子=8
フッ素の価電子=7*4(四つのフッ素原子があるので、それを4で乗算します)
Xef4の価電子の総数:8 + 7*4
:8+28
:36
したがって、Xef4には合計36個の価電子があります。
Xef4ルイス構造
四フッ化キセノンの価電子がわかったので、そのルイス構造を描くのが簡単になります。 このルイスドット構造は、分子内の個々の原子の周りの価電子とそれが形成する結合の絵の表現です。
構造中の結合は線を用いて示され、結合形成に関与しない電子は点として示される。 任意の結合を形成しない電子は、非結合電子または電子の孤立電子対と呼ばれています。
ここで、キセノンは最も電気陰性原子であるため、中心に配置し、他のすべてのフッ素原子を次のように配置します。

すべての原子を配置したので、各フッ素とキセノン原子の間の結合を示しましょう。 分子内の各結合は2つの電子を占有し、この分子内に4つの単結合があるため、36のうち8つの電子が使い果たされます。
原子の周りに残りの原子価電子を配置し始めます。 一つの電子が結合を作るために使用されたように、各フッ素原子は、その周りに六つの価電子を持つことになります。 あなたは私たちがすでにフッ素原子の周りに28のうち24の電子を配置していることに気づくかもしれません。
残りの非結合電子または電子の孤立電子対は、オクテット則の例外であるため、キセノン上に配置されます。
キセノン上に非結合電子のこれらの二つのペアを配置し、今、あなたはキセノン上の電子の二つの孤立電子対と各フッ素原子上の六つの非結合電子
Xef4ハイブリダイゼーション
中心キセノン原子の軌道はハイブリダイゼーションされ、新しいハイブリダイゼーション軌道が形成される。 キセノンは、その5p軌道に六つの電子と5s軌道に二つの電子を持っています。 キセノンの基底状態ではd軌道とf軌道に電子は存在しない。 しかし、この原子が励起状態にあるとき、p軌道の2つの電子がd軌道に移動し、その結果、合計で4つの不対電子が存在する。 そのうちの2つはp軌道にあり、他の2つの不対電子はd軌道にあります。 これらのハイブリダイズ軌道は、Xef4でsp3d2ハイブリダイズにつながる。
Xef4分子幾何学
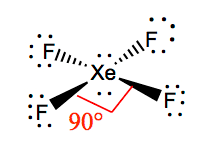
ルイス構造を知っていれば、与えられた分子の分子幾何学を理解する方が簡単です。 キセノンは二つの孤立電子対を持っているので、これらの孤立電子対が反発力を避けるのを助ける構造をとるでしょう。 これらの反発を最小限に抑えるために、孤立電子対は垂直平面内にあります。 そして、4つのフッ素原子があるので、分子はその分子幾何学が正方形の平面であるような配置を有する。 Xef4は八面体の電子幾何学を持ち、四フッ化キセノンの分子幾何学を正方形の平面にしている。

Xef4結合角
F-Xe-Fの結合角は90度であり、孤立対は180度の角度を有する。 フッ素原子は互いに90度に位置し、その結果、分子の平面内の電子の対称的な分布が得られる。 これらの結合角は、正方形の平面分子幾何学の形成に寄与する。 p>
Xef4極性-Xef4極性または非極性ですか? キセノン原子とフッ素原子の間の結合は極性であるが、Xef4は非極性分子である。 どのように疑問に思いますか? 全てのXe-F結合は相互に反対しており,双極子モーメントの和はゼロになっている。 キセノン原子上には四つの電子があり、それらは非結合電子対として局在している。 分子内の原子と電子の全体的な配置は、双極子のベクトル和がゼロになるようなものであるため、Xef4は非極性分子です。
おわりに
四フッ化キセノンは、比較的理解しやすい分子の一つです。 そのルイス構造は、すべてのフッ素原子が対称パターンで配置されているので、最も複雑な構造の一つです。 分子中の孤立電子対は、それらの反発力を最小に保つために、八面体形状の垂直平面に位置する。 このブログ記事を要約すると、Xef4は36個の価電子を持っていると言うことができます。
このブログ記事を要約すると、Xef4は36個の価電子を これは、キセノンの中心原子上に非結合電子の二つの孤立電子対を持っています。 分子は八面体電子幾何学と正方形の平面分子幾何学を持っています。 Xef4は非極性分子であり、sp3d2ハイブリダイゼーションを有する。