De XeF4 of Xenon Tetrafluoride is een chemische verbinding gemaakt van Xenon-en Fluorideatomen. Het is ‘ s werelds eerste binaire verbinding ontdekt. Het is een type edelgas met de chemische vergelijking van
Xe +2 F2 -> XeF4
De XeF4 heeft een vast wit uiterlijk en heeft een dichtheid van 4,040 g cm−3 in vaste vorm. Onder normale omstandigheden lijkt het op een kleurloze kristallijn. Het heeft een sublieme temperatuur van 115.7 graden Celsius of 240.26 graden Fahrenheit. Net als de andere Xenonfluoriden heeft het Xenon Tetrafluoride een exergonische vorming. Bij normale temperatuur en druk blijft het in stabiele conditie. Het reageert onmiddellijk met water en geeft moleculaire zuurstof, waterstoffluoride en puur xenongas vrij.
| Name of molecule | Xenon Tetrafluoride (XeF4) |
| No of Valence Electrons in the molecule | 36 |
| Hybridization of XeF4 | sp3d2 hybridization |
| Bond Angles | 90 degrees and 180 degrees |
| Molecular Geometry of XeF4 | Square Planar |
To know more about its physical properties and chemical properties, one needs to know its Lewis structuur en moleculaire geometrie. Laten we de Lewis structuur van Xenon tetrafluoride achterhalen.
om de Lewis-structuur te maken, moeten we de valentie-elektronen van XeF4 kennen om zijn structuur te maken en de plaatsing van atomen in het molecuul kennen.
inhoud
Xef4 valentie-elektronen
in dit molecuul hebben we één atoom Xenon en vier atomen Fluor. We zullen de valentie-elektronen van beide atomen berekenen om het totale aantal valentie-elektronen van XeF4 te bepalen.
valentie-elektronen van Xenon = 8
valentie-elektronen van Fluor = 7 * 4 (aangezien er vier fluor-atomen zijn, zullen we het vermenigvuldigen met 4)
totaal aantal valentie-elektronen van Xef4: 8 + 7*4
: 8 + 28
: 36
daarom zijn er in totaal 36 valentie-elektronen in XeF4.
Xef4 Lewis structuur
nu we de valentie-elektronen van Xenon Tetrafluoride kennen, is het makkelijker voor u om de Lewis structuur te tekenen. Deze Lewis – puntstructuur is een picturale representatie van valentie-elektronen rond individuele atomen in een molecuul samen met de binding die het vormt.
de bindingen in de structuur worden weergegeven met behulp van lijnen, terwijl de elektronen die niet deelnemen aan de bindingen als punten worden weergegeven. Elektronen die geen binding vormen worden niet-bindende elektronen of eenzame paren van elektronen genoemd.
aangezien Xenon het minst elektronegatieve atoom is, plaatsen we het in het Midden en alle andere fluoratomen eromheen als volgt:

nu we alle atomen hebben geplaatst laten we de bindingen tussen elk fluor-en Xenonatoom tonen. Elke binding in het molecuul neemt twee elektronen op, en omdat er vier afzonderlijke bindingen in dit molecuul zijn, worden 8 van de 36 elektronen opgebruikt.
plaats de rest van de valentie-elektronen rond de atomen. Elk fluor atoom zal zes valentie-elektronen rond het hebben, zoals een elektron werd gebruikt om de binding te maken.
je zou kunnen merken dat we al 24 van de 28 elektronen rond de fluor-atomen hebben geplaatst. De resterende niet-gebonden elektronen of eenzame paren van elektronen zullen op Xenon worden geplaatst aangezien het een uitzondering op de octetregel is.
plaats deze twee paren van niet-gebonden elektronen op Xenon, en nu heb je een Lewis structuur waar er twee eenzame paren van elektronen op Xenon en zes niet-gebonden elektronen op elk Fluor atoom.
XeF4 hybridisatie
de orbitalen van het centrale Xenonatoom zijn gehybridiseerd, wat resulteert in de vorming van nieuwe gehybridiseerde orbitalen. Xenon heeft zes elektronen in zijn 5P orbitalen en twee elektronen in 5s orbitalen. Er zijn geen elektronen in d-orbitalen en f-orbitalen in de grondtoestand van Xenon. Maar als dit atoom in een opgewonden toestand is, gaan twee elektronen in de p-orbitalen over naar d-orbitalen; als gevolg daarvan zijn er in totaal vier ongepaarde elektronen. Waarvan er twee in p-orbitalen zitten, en de andere twee ongepaarde elektronen in d-orbitalen. Deze gehybridiseerde orbitalen leiden tot sp3d2 hybridisatie in XeF4.
Xef4 moleculaire meetkunde
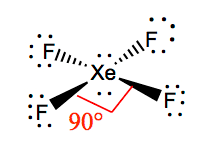
Het is gemakkelijker om de moleculaire meetkunde van een bepaald molecuul te begrijpen zodra we de Lewis-structuur kennen. Aangezien Xenon twee eenzame paren elektronen heeft, zal het een structuur opnemen die deze eenzame paren helpt de afstotingskrachten te vermijden. Om deze afstotingen tot een minimum te beperken, zullen de eenzame paren zich in een loodrecht vlak bevinden. En omdat er vier fluor-atomen zijn, zal het molecuul een zodanige opstelling hebben dat zijn moleculaire geometrie vierkant vlak is. XeF4 heeft een elektronische meetkunde van octaëdraal, waardoor de moleculaire meetkunde van Xenon Tetrafluoride vierkant vlak is.

XeF4 Bindingshoeken
De bindingshoeken van F-Xe-F zijn 90 graden, en eenzame paren hebben hoeken van 180 graden. De fluoratomen bevinden zich op 90 graden ten opzichte van elkaar, wat resulteert in de symmetrische verdeling van de elektronen in het molecuulvlak. Deze bindingshoeken dragen bij aan de vorming van vierkante vlakke moleculaire meetkunde.
Xef4 polariteit – is XeF4 polair of niet-polair?
hoewel de bindingen tussen Xenon-en fluor-atomen polair zijn, is XeF4 een niet-polair molecuul. Vraag je je af hoe? Alle XE-F bindingen zijn onderling tegengesteld, waardoor de som van dipoolmoment nul is. Aangezien er vier elektronen op het Xenonatoom zijn, die als niet-bindende paren van elektronen worden gelokaliseerd. Aangezien de algemene rangschikking van de atomen en elektronen in het molecuul zodanig is dat de vector som van de dipolen nul is, is XeF4 een niet-polair molecuul.
slotopmerkingen
Xenontetrafluoride is een van die moleculen die relatief gemakkelijk te begrijpen zijn. De Lewis-structuur is een van de minst gecompliceerde structuren, omdat alle Fluor-atomen in het symmetrisch patroon zijn gerangschikt. De eenzame paren in het molecuul bevinden zich in een loodrecht vlak in een octaëdrische vorm om hun afstotende krachten op een minimum te houden.
om deze blogpost samen te vatten, kunnen we zeggen dat XeF4 36 valentie-elektronen heeft. Het heeft twee eenzame paren van niet-gebonden elektronen op het centrale atoom van Xenon. Het molecuul heeft een octaëdrale elektronenmeetkunde en een vierkante vlakke moleculaire meetkunde. XeF4 is een niet-polaire molecule en heeft sp3d2 kruising.