XeF4-eller Xenontetrafluorid är en kemisk förening gjord av Xenon-och fluoratomer. Det är världens första binära förening upptäckt. Det är en typ av ädelgas som har den kemiska ekvationen
Xe + 2 F2 -> XeF4
XeF4 har ett fast vitt utseende och har en densitet av 4,040 g cm−3 i fast form. Under vanliga förhållanden verkar det som en färglös kristallin. Den har en sublim temperatur på 115,7 grader Celsius eller 240,26 grader Fahrenheit. Samma som de andra Xenonfluoriderna har Xenontetrafluoriden en exergonisk bildning. Vid normal temperatur och tryck förblir den i stabilt tillstånd. Det reagerar direkt med vatten och släpper ut molekylärt syre, vätefluorid och ren xenongas.
| Name of molecule | Xenon Tetrafluoride (XeF4) |
| No of Valence Electrons in the molecule | 36 |
| Hybridization of XeF4 | sp3d2 hybridization |
| Bond Angles | 90 degrees and 180 degrees |
| Molecular Geometry of XeF4 | Square Planar |
To know more about its physical properties and chemical properties, one needs to know its Lewis struktur och molekylär geometri. Låt oss ta reda på Lewis-strukturen för Xenontetrafluorid.
För att göra Lewis-strukturen behöver vi veta valenselektronerna i XeF4 för att göra sin struktur och känna till placeringen av atomer i molekylen.
innehåll
XeF4 valenselektroner
i denna molekyl har vi en atom Xenon och fyra atomer Fluor. Vi kommer att beräkna valenselektronerna för båda dessa atomer för att bestämma det totala antalet valenselektroner av XeF4.
valenselektroner av Xenon = 8
valenselektroner av fluor = 7 * 4 ( eftersom det finns fyra fluoratomer, kommer vi att multiplicera det med 4)
Totalt antal valenselektroner av Xef4: 8 + 7*4
: 8 + 28
: 36
därför finns det totalt 36 valenselektroner i XeF4.
XeF4 Lewis Structure
Nu när vi känner till valenselektronerna av Xenontetrafluorid, blir det lättare för dig att rita sin Lewis-struktur. Denna Lewis dot-struktur är en bildrepresentation av valenselektroner runt enskilda atomer i en molekyl tillsammans med bindningen den bildar.
bindningarna i strukturen visas med hjälp av linjer, medan elektronerna som inte deltar i bindningsbildningen visas som prickar. Elektroner som inte bildar någon bindning kallas icke-bindande elektroner eller ensamma elektronpar.
här eftersom Xenon är den minst elektronegativa atomen kommer vi att placera den i mitten och alla andra fluoratomer runt den så här:

Nu när vi har placerat alla atomer, låt oss visa bindningar mellan varje fluor och Xenonatom. Varje bindning i molekylen tar upp två elektroner, och eftersom det finns fyra enkelbindningar i denna molekyl används 8 elektroner av 36.
börja placera resten av valenselektronerna runt atomerna. Varje fluoratom kommer att ha sex valenselektroner runt den, eftersom en elektron användes för att göra bindningen.
Du kanske märker att vi redan har placerat 24 elektroner av 28 runt fluoratomerna. De återstående icke-bindande elektronerna eller ensamma elektronpar kommer att placeras på Xenon eftersom det är ett undantag från oktettregeln.
placera dessa två par icke-bonding elektroner på Xenon, och nu har du en Lewis-struktur där det finns två ensamma par elektroner på Xenon och sex icke-bonding elektroner på varje fluoratom.
Xef4 hybridisering
den centrala Xenonatomens orbitaler hybridiseras, vilket resulterar i bildandet av nya hybridiserade orbitaler. Xenon har sex elektroner i sina 5P-orbitaler och två elektroner i 5S-orbitaler. Det finns inga elektroner i d-orbitaler och f-orbitaler i grundtillståndet för Xenon. Men när denna atom är i ett upphetsat tillstånd flyttar två elektroner i p-orbitalerna till d-orbitaler; som ett resultat finns det totalt fyra oparade elektroner. Av vilka två är i p-orbitaler, och de andra två oparade elektronerna är i d-orbitaler. Dessa hybridiserade orbitaler leder till sp3d2-hybridisering i XeF4.
Xef4 molekylär geometri
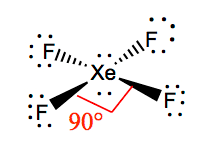
det är lättare att förstå molekylär geometri för en given molekyl när vi känner till dess Lewis-struktur. Eftersom Xenon har två ensamma par elektroner, kommer det att ta upp en struktur som hjälper dessa ensamma par att undvika repulsionskrafterna. För att hålla dessa repulsioner åtminstone kommer de ensamma paren att vara i ett vinkelrätt plan. Och eftersom det finns fyra fluoratomer, kommer molekylen att ha ett arrangemang så att dess molekylära geometri är kvadratisk plan. XeF4 har en elektronisk geometri av oktaedrisk, vilket gör molekylgeometrin för Xenontetrafluorid kvadratisk plan.

XeF4 Bindningsvinklar
bindningsvinklarna för F-Xe-F är 90 grader och ensamma par har vinklar på 180 grader. Fluoratomerna är belägna vid 90 grader mot varandra, vilket resulterar i den symmetriska fördelningen av elektronerna i molekylens plan. Dessa bindningsvinklar bidrar till bildandet av kvadratisk plan molekylär geometri.
Xef4 polaritet – är XeF4 polär eller icke-polär?
även om bindningarna mellan Xenon – och fluoratomer är polära är XeF4 en icke-polär molekyl. Undrar hur? Alla XE-F-bindningarna är i opposition med varandra ömsesidigt, vilket gör summan av dipolmomentet noll. Eftersom det finns fyra elektroner på xenonatomen, som är lokaliserade som icke-bindande elektronpar. Eftersom det övergripande arrangemanget av atomerna och elektronerna i molekylen är sådan att vektorsumman av dipolerna är noll, är XeF4 en icke-polär molekyl.
avslutande anmärkningar
Xenontetrafluorid är en av de molekyler som är relativt lätt att förstå. Dess Lewis-struktur är en av de minst komplicerade strukturerna, eftersom alla fluoratomer är ordnade i det symmetriska mönstret. De ensamma paren i molekylen är belägna i ett vinkelrätt plan i en oktaedrisk form för att hålla sina repulsiva krafter på ett minimum.
för att sammanfatta detta blogginlägg kan vi säga att XeF4 har 36 valenselektroner. Den har två ensamma par icke-bonding elektroner på den centrala atomen av Xenon. Molekylen har oktaedrisk elektrongeometri och kvadratisk plan molekylär geometri. XeF4 är en icke-polär molekyl och har sp3d2-hybridisering.